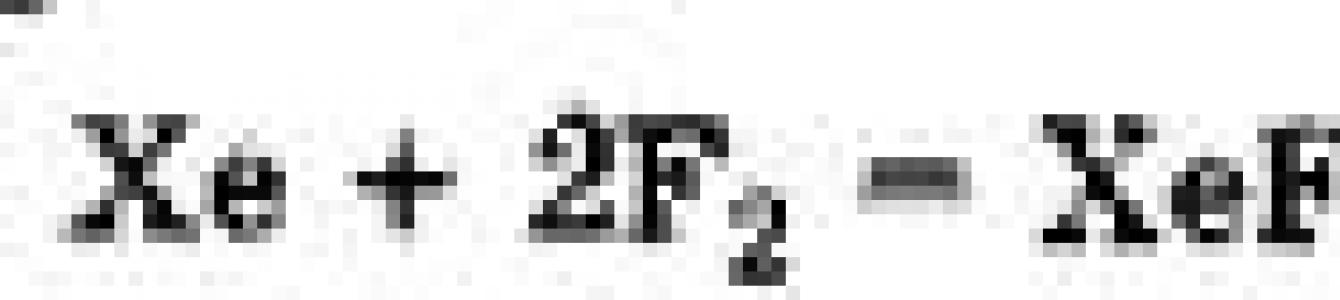ОПРЕДЕЛЕНИЕ
Галогены – элементы VIIА группы – фтор (F), хлор (Cl), бром (Br) и йод (I).
Электронная конфигурация внешнего энергетического уровня галогенов ns 2 np 5 . Поскольку, до завершения энергетического уровня галогенам не хватает всего 1-го электрона, в ОВР они чаще всего проявляют свойства окислителей. Степени окисления галогенов: от «-1» до «+7». Единственный элемент группы галогенов – фтор – проявляет только одну степень окисления «-1» и является самым электроотрицательным элементом.
Молекулы галогенов двухатомны: F 2 , Cl 2 , Br 2 , I 2 . С ростом заряда ядра атома химического элемента, т.е. при переходе от фтора к йоду окислительная способность галогенов снижается, что подтверждается способностью вытеснения нижестоящих галогенов вышестоящими из галогеноводородных кислот и их солей:
Br 2 + 2HI = I 2 + 2HBr
Cl 2 + 2KBr = Br 2 + 2KCl
Физические свойства галогенов
При н.у. фтор – газ светло-желтого цвета, обладающий резким запахом. Ядовит. Хлор – газ светло-зеленого цвета, также как и фтор имеет резкий запах. Сильно ядовит. При повышенном давлении и комнатной температуре легко переходит в жидкое состояние. Бром – тяжелая жидкость красно-бурого цвета с характерным неприятным резким запахом. Жидкий бром, а также его пары сильно ядовиты. Бром плохо растворяется в воде и хорощо в неполярных растворителях. Йод – твердое вещество темно-серого цвета с металлическим блеском. Пары йода имеют фиолетовый цвет. Йод легко возгоняется, т.е. переходит в газообразное состояние из твердого, при этом минуя жидкое состояние.
Получение галогенов
Галогены можно получить при электролизе растворов или расплавов галогенидов:
MgCl 2 = Mg + Cl 2 (расплав)
Наиболее часто галогены получают по реакции окисления галогенводородных кислот:
MnO 2 + 4HCl = MnCl 2 + Cl 2 +2H 2 O
K 2 Cr 2 O 7 + 14HCl = 3Cl 2 + 2KCl +2CrCl 3 +7H 2 O
2KMnO 4 +16HCl = 2MnCl 2 +5Cl 2 +8H 2 O +2KCl
Химические свойства галогенов
Наибольшей химической активностью обладает фтор. Большинство химических элементов даже при комнатной температуре взаимодействует с фтором, выделяя большое количество теплоты. Во фторе горит даже вода:
2H 2 O + 2F 2 =4HF + O 2
Свободный хлор менее реакционноспособен, чем фтор. Он непосредственно не реагирует с кислородом, азотом и благородными газами. Со всеми остальными веществами он взаимодействует подобно фтору:
2Fe + Cl 2 = 2FeCl 3
2P + 5Cl 2 = 2PCl 5
При взаимодействии хлора с водой на холоде происходит обратимая реакция:
Cl 2 + H 2 O↔HCl +HClO
Смесь, представляющую собой продукты реакции, называют хлорной водой.
При взаимодействии хлора с щелочами на холоде образуются смеси хлоридов и гипохлоритов:
Cl 2 + Ca(OH) 2 = Ca(Cl)OCl + H 2 O
При растворении хлора в горячем растворе щелочи происходит реакция:
3Cl 2 + 6KOH=5KCl +KClO 3 +3H 2 O
Бром, как и хлор растворяется в воде и, частично реагируя с ней, образует так называемую «бромную воду», тогда как йод в воде практически нерастворим.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие йода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н 2 + I 2 = 2HI - 53 кДж.
Примеры решения задач
ПРИМЕР 1
| Задание | Рассчитайте объем хлора (н. у.), который прореагировал с иодидом калия, если при этом образовался йод массой 508 г | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Решение | Запишем уравнение реакции:
Cl 2 + 2KI = I 2 + 2KCl Найдем количество вещества образовавшегося йода: v(I 2)=m(I 2)/M(I 2) v(I 2)=508/254=2 моль По уравнению реакции количество вещества хлора. Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат. В свободном состоянии галогены образуют вещества, состоящие из двухатомных молекул F 2 , Cl 2 , Br 2 , I 2 . НАХОЖДЕНИЕ В ПРИРОДЕ Галогены в природе находятся только в виде соединений. Фтор встречается исключительно в виде солей, рассеянных по различным горным породам. Общее содержание фтора в земной коре составляет 0,02% атомов. Практическое значение имеют минералы фтора: CaF 2 - плавиковый шпат, Na 2 AlF 6 - криолит, Ca 5 F(PO 4) 3 - фторапатит.
Бром встречается в природе в виде солей натрия и калия вместе с солями хлора, а также в воде соленых озер и морей. Бромиды металлов содержатся в морской воде. В подземных буровых водах, имеющих промышленное значение, содержание брома составляет от 170 до700мг/л. Общее содержание брома в земной коре 3*10-5% атомов. Соединения
йода
имеются в морской воде, но в столь малых количествах, что
непосредственное выделение их из воды очень затруднительно. Однако существуют
некоторые водоросли, которые накапливают йод в своих тканях, например
ламинарии. Зола этих водорослей служит сырьем для получения йода. Значительное
количество йода(от 10 до 50мг/л.) содержатся в подземных буровых водах.
Содержание йода в земной коре 4*10-6 % атомов. Существуют незначительные залежи
солей йода - KIO 3 и KIO 4 - В Чили и Боливии. Общая масса астата на земном шаре по оценкам не превышает 30 г. Таблица. Электронное строение и некоторые свойства атомов и молекул галогенов
1) Общая электронная конфигурация внешнего энергетического уровня - nS 2 nP 5 . 2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы. 3) С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность. ПОЛУЧЕНИЕ ГАЛОГЕНОВ 1. Электролиз растворов и расплавов галогенидов: 2NaCl + 2H 2 O = Cl 2 + H 2 + 2NaOH 2 KF = 2 K + F 2 (единственный способ полученияя F 2 ) 2. Окисление галогенводородов: 2 KMnO 4 +16 HCl =2 KCl +2 MnCl 2 +5 Cl 2 +8 H 2 O – Лабораторный способ получения хлора 14HBr+K 2 Cr 2 O 7 =2KBr+2CrBr 3 +3Br 2 +7H 2 O MnO 2 + 4 HHal = MnHal 2 + Hal 2 + 2 H 2 O – Лабораторный - (Для получения хлора, брома, иода) 3. Промышленный способ – окисление хлором (для брома и йода): 2KBr+Cl 2 =2KCl+Br 2 2KI + Cl 2 =2KCl + I 2 Химические свойства Рассмотрим свойства галогенов на примере хлора:
ПРИМЕНЕНИЕ ГАЛОГЕНОВ
При обычных условиях F 2 и Сl 2 -газы, Вr 2 - жидкость, I 2 и At твердые вещества. Интенсивность цвета также различна: с увеличением атомного радиуса, а также массы ядра, цвет становится темнее (фтор бледно-желтый, хлор - желтый, бром - темно-красно-коричневый, а астат темно-фиолетовый). В твердом состоянии галогены имеют кристаллическое строение. Жидкие галогены хорошо проводят электрический ток. Растворимость галогенов в воде.
Характеристикой галогенов является их окислительная способность. Самый сильный окислитель (по шкале Полинга) - это F 2 , который реагирует со всеми химическими элементами. Реакционная способность галогенов падает с увеличением радиуса атома. Поэтому I 2 может выступать в качестве восстановителя. Соединения с водородом носят название - галогенводороды (хлороводород, иодоводород, фтороводород), которые являются сильными кислотами (за исключением плавиковой кислоты - она средней силы). Все галогены (кроме фтора) образуют неустойчивые кислородсодержащие кислоты, где Х - F, Cl, Br, I :
Степень окисления возрастает, кислотные свойства увеличиваются, окислительная способность падает. Фтор вытесняет хлор из его соединений с более электроположительными элементами, хлор вытесняет бром, а бром - йод: F 2 + 2НCl → 2НF + Cl 2, С другой стороны, йод вытесняет бром и хлор из кислородсодержащих кислот и их солей, в которых галогены заряжены положительно: I 2 + 2НСIO 3 → 2НIO 3 + Сl 2, Галогены реагируют со большим количеством органических соединений: в реакциях замещения, присоединения по кратной связи и т.д. Многие углеводороды горят или взрываются в атмосфере F 2 . В свободном виде не существуют в природе, а в качестве составляющих компонентов повсеместно распространены в многочисленных природных минералах, присутствуют в соленой воде. Все галогены имеют ядовитые пары (ядовитые газы «Зоман», «Зарин») и могут нанести непоправимый вред здоровью, но в то же время обладают бактерицидным действием. Галогены фтор F, хлор С1, бром Вг, иод I являются элементами группы VILA. Электронная конфигурация валентной оболочки атомов галогенов в основном состоянии ns 2 np 5 . Наличие пяти электронов на внешней р-орбитали, в том числе одного неспаренного, является причиной высокого сродства галогенов к электрону. Присоединение электрона приводит к образованию галогенид-анионов (F-, С1-, Вг-, I-) с устойчивой 8-электронной оболочкой ближайшего благородного газа. Галогены - ярко выраженные неметаллы. Самый электроотрицательный элемент фтор имеет в соединениях только одну степень окисления - 1, так как всегда является акцептором электронов. Другие галогены в соединениях могут иметь степень окисления от -1 до +7. Положительные степени окисления галогенов вызваны переходом их валентных электронов на свободные d-орбитали внешнего уровня (разд. 2.1.3) при образовании связей с более электроотрицательными элементами. Молекулы галогенов двухатомные: F 2 , С1 2 , Вг 2 , I 2 . При стандартных условиях фтор и хлор - газы, бром - летучая жидкость (Tкип = 59 °С), а иод - твердый, но он легко возгоняется (переходит в газообразное состояние, минуя жидкое). Окислительно-восстановительные свойства. Галогены являются сильными окислителями, вступая во взаимодействие почти со всеми металлами и многими неметаллами: Особенно высокую химическую активность проявляет фтор, который при нагревании реагирует даже с благородными газами ксеноном, криптоном и радоном:
Химическая активность галогенов уменьшается от фтора к иоду, так как с увеличением радиуса атома способность галогенов присоединять электроны уменьшается:
Более активный галоген всегда вытесняет менее активный из его соединений с металлами. Так, фтор вытесняет все другие галогены из их галогенидов, а бром - только иод из иодидов: Различная окислительная способность галогенов проявляется и в их действии на организм. Газообразные хлор и фтор из-за очень сильных окислительных свойств являются мощными отравляющими веществами, вызывающими тяжелые поражения легких и слизистых оболочек глаз, носа и гортани. Иод - более мягкий окислитель, проявляющий антисептические свойства, поэтому он широко используется в медицине. Различия в окислительно-восстановительных свойствах галогенов проявляются и при их взаимодействии с водой. Фтор окисляет воду, при этом восстановителем выступает атом кислорода молекулы волы: Взаимодействие остальных галогенов с водой сопровождается окислительно-восстановительной дисмутацией их атомов. Так, при реакции хлора с водой один из атомов молекулы хлора, присоединяя электрон от другого атома, восстанавливается, а другой атом хлора, отдавая электрон, окисляется. При этом образуется хлорная вода, содержащая хлористый водород (соляную кислоту) и гипохлористую (хлорноватистую) кислоту: Реакция является обратимой, а ее равновесие сильно смещено влево. Гипохлористая кислота неустойчива и легко распадается, особенно на свету, с образованием очень сильного окислителя -атомарного кислорода: Таким образом, хлорная вода содержит в различных концентрациях три окислителя с разной окислительной способностью: молекулярный хлор, гипохлористую кислоту и атомарный кислород, сумму которых часто называют "активный хлор" . Образующийся атомарный кислород обесцвечивает красители и убивает микробы, что объясняет отбеливающее и бактерицидное действие хлорной воды. Гипохлористая кислота - более сильный окислитель, чем газообразный хлор. Она реагирует с органическими соединениями RH и как окислитель, и как хлорирующий реагент: Поэтому при хлорировании питьевой воды, содержащей в качестве примесей органические вещества, они могут превратиться в более токсичные хлорорганические соединения RC1. Это обязательно следует учитывать при разработке способов очистки воды и их применении. При добавлении к хлорной воде щелочи равновесие смещается вправо вследствие нейтрализации гипохлористой и соляной кислот: Полученный раствор смеси солей, называемый жавелевой водой, используется как отбеливающее и дезинфицирующее средство. Эти свойства обусловлены тем, что гипохлорит калия под действием СО2 + Н 2 0 и в результате гидролиза превращается в неустойчивую гипохлористую кислоту, образующую атомарный кислород. В результате жавелевая вода разрушает красящие вещества и убивает микробы. При действии газообразного хлора на влажную гашеную известь Са(ОН) 2 получают смесь солей СаСl 2 и Са(0С1) 2 , называемую хлорной известью: Хлорную известь можно рассматривать как смешанную кальциевую соль соляной и гипохлористой кислот CaCl(OCl). Во влажном воздухе хлорная известь, взаимодействуя с водой и углекислым газом, постепенно выделяет гипохлористую кислоту, которая обеспечивает ее отбеливающее, дезинфицирующее и дегазирующие свойства: При действии на хлорную известь соляной кислоты происходит выделение свободного хлора: При нагревании гипохлористая кислота в результате окислительно-восстановительного диспропорционирования разлагается с образованием соляной и хлорноватой кислот:
При пропускании хлора через горячий раствор щелочи, например КОН, образуются хлорид калия и хлорат калия КClO 3 (бертолетова соль): Окислительная способность анионов кислородсодержащих кислот хлора в водных растворах в ряду СlO - - СlO4(-) уменьшается несмотря на возрастание в них степени окисления хлора:
Это объясняется повышением устойчивости анионов в указанном ряду вследствие усиления делокализации их отрицательного заряда. В то же время перхлораты LiC10 4 , КСlO 4 в сухом состоянии при высоких температурах являются сильными окислителями и используются для минерализации различных биоматериалов при определении в них содержащихся неорганических компонентов. Анионы галогенов (кроме F-) способны отдавать электроны, поэтому они являются восстановителями. Восстановительная способность галогенид-анионов по мере возрастания их радиуса увеличивается от хлорид-аниона к иодид-аниону:
Так, иодоводородная кислота окисляется кислородом воздуха уже при обычной температуре:
Соляная кислота не окисляется кислородом, и поэтому хлорид-анион устойчив в условиях организма, что очень важно с позиции физиологии и медицины. Кислотно-основные свойства. Водородгалогениды HF, НС1, HBr, HI вследствие полярности их молекул хорошо растворяются в воде. При этом происходит гидратация молекул, приводящая к их диссоциации с образованием гидратированных протонов и галогенид-анионов. Сила кислот в ряду HF, НС1, HBr, HI возрастает вследствие увеличения радиуса и поляризуемости анионов от F- к I-. Соляная кислота как компонент желудочного сока играет важную роль в процессе пищеварения. В основном за счет соляной кислоты, массовая доля которой в желудочном соке составляет 0,3 %, его рН поддерживается в интервале от 1 до 3. Соляная кислота способствует переходу фермента пепсина в активную форму, что обеспечивает переваривание белков за счет гидролитического расщепления пептидных связей с образованием различных аминокислот: Определение содержания соляной кислоты и других кислот в желудочном соке было рассмотрено в разд. 8.3.3. В ряду кислородсодержащих кислот хлора по мере увеличения его степени окисления сила кислот увеличивается.
Это связано с увеличением полярности связи О-Н из-за смещения ее электронной плотности к атому хлора, а также из-за повышения устойчивости анионов. Комплексообразующие свойства. Анионы галогенов склонны к комплексообразованию в качестве лигандов. Устойчивость галогенидных комплексов обычно уменьшается в ряду F- > Сl- > Вr- > > I-. Именно процессом комплексообразования объясняется токсическое действие фторид-анионов, которые, образуя фторидные комплексы с катионами металлов, входящих в активные центры ферментов, подавляют их активность. Интересные комплексообразующие свойства проявляет молекула иода. Так, растворимость молекулярного иода в воде резко возрастает в присутствии иодида калия, что связано с образованием комплексного аниона Невысокая устойчивость этого комплексного иона обеспечивает наличие молекулярного иода в растворе. Поэтому в медицине используется в качестве бактерицидного средства водный раствор иода с добавлением KI. Кроме того, молекулярный иод образует комплексы включения с крахмалом (разд. 22.3) и поливиниловым спиртом (синий иод). В этих комплексах молекулы иода или их ассоциаты с иодид-анионами заполняют каналы, образованные спиралевидной структурой соответствующих полигидроксиполимеров. Комплексы включения не очень устойчивы и способны постепенно отдавать молекулярный иод. Поэтому такой препарат, как синий иод, является эффективным, но мягким бактерицидным средством пролонгированного действия. Биологическая роль и применение галогенов и их соединений в медицине. Галогены в виде различных соединений входят в состав живых тканей. В организме все галогены имеют степень окисления - 1. При этом хлор и бром существуют в виде гидратированных анионов Сl- и Вr-, а фтор и иод входят в состав нерастворимых в воде биосубстратов:. Соединения фтора являются компонентами костной ткани, ногтей и зубов. Биологическое действие фтора прежде всего связано с проблемой болезней зубов. Фторид-анион, замещая в гидроксиапатите гидроксид-ион, образует слой защитной эмали из твердого фторапатита: Фторирование питьевой воды до концентрации фторид-иона 1 мг/л и добавление фторида натрия в зубную пасту значительно снижают кариес зубов у населения. В то же время при концентрации фторид-аниона в питьевой воде выше 1,2 мг/л повышается хрупкость костей, зубной эмали и появляется общее истощение организма, называемое флуорозом. Хлорид-анионы обеспечивают ионные потоки через клеточные мембраны, участвуют в поддержании осмотического гомеостаза, создают благоприятную среду для действия и активации протолитических ферментов желудочного сока. Бромид-анионы в организме человека локализуются преимущественно в гипофизе и других железах внутренней секреции. Установлено наличие динамической связи между содержанием в организме бромид- и хлорид-анионов. Так, повышенное содержание в крови бромид-анионов способствует быстрому выделению почками хлорид-анионов. Бромиды локализуются в основном в межклеточной жидкости. Они усиливают тормозные процессы в нейронах коры головного мозга, в связи с чем бромиды калия, натрия и бромкамфора применяются в фармакологии. Иод и его соединения влияют на синтез белков, жиров и гормонов. Больше половины количества иода находится в щитовидной железе в связанном состоянии в виде тиреоидных гормонов. При недостаточном поступлении иода в организм развивается эндемический зоб. С целью профилактики этого заболевания к поваренной соли добавляют NaI или KI (1-2 г на 1 кг NaCl). Таким образом, все галогены необходимы для нормального функционирования живых организмов.
Подгруппу галогенов составляют элементы фтор, хлор, бром и иод. Электронные конфигурации внешнего валентного слоя галогенов относятся к типу соответственно у фтора, хлора, брома и иода). Такие электронные конфигурации обусловливают типичные окислительные свойства галогенов - способностью присоединять электроны обладают все галогены, хотя при переходе к иоду окислительная способность галогенов ослабляется. При обычных условиях галогены существуют в виде простых веществ, состоящих из двухатомных молекул типа с ковалентными связями. Физические свойства галогенов существенно различаются: так, при нормальных условиях фтор - газ, который трудно сжижается, хлор - также газ, но сжижается легко, бром - жидкость, иод - твердое вещество. Химические свойства галогенов.В отличие от всех других галогенов фтор во всех своих соединениях проявляет только одну степень окисления 1- и не проявляет переменной валентности. Для других галогенов наиболее характерной степенью окисления также является 1-, однако благодаря наличию свободных -орбиталей на внешнем уровне они могут проявлять и другие нечетные степени окисления от до за счет частичного или полного распаривания валентных электронов. Наибольшей активностью обладает фтор. Большинство металлов даже при комнатной температуре загорается в его атмосфере, выделяя большое количество теплоты, например: Без нагревания фтор реагирует и со многими неметаллами (водородом - см. выше, ), выделяя при этом также большое количество теплоты: При нагревании фтор окисляет все другие галогены по схеме: где , причем в соединениях степени окисления хлора, брома и иода равны . Наконец, при облучении фтор реагирует даже с инертными газами: Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер: Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов, например:
Для этих реакций, как и для всех других, очень важны условия их протекания. Так, при комнатной температуре хлор с водородом не реагирует; при нагревании эта реакция протекает, но оказывается сильно обратимой, а при мощном облучении протекает необратимо (со взрывом) по цепному механизму. Хлор вступает в реакции со многими сложными веществами, например замещения и присоединения с углеводородами:
Хлор способен при. нагревании вытеснять бром или иод из их соединений с водородом или металлами:
а также обратимо реагирует с водой: Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой. Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала 1- (в ), у других (в хлорноватистой кислоте ). Такая реакция - пример реакции самоокисления-самовосстановления, или диспропорционирования. Напомним, что хлор может таким же образом реагировать (диспропорционировать) с щелочами (см. раздел «Основания» в § 8). Химическая активность брома меньше, чем фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора. Являясь более «мягким» реагентом, бром находит широкое применение в органической химии. Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды». Получение галогенов.Наиболее распространенным технологическим методом получения фтора и хлора является электролиз расплавов их солей (см. § 7). Бром и иод в промышленности, как правило, получают химическим способом. В лаборатории хлор получают действием различных окислителей на соляную кислоту, например: Еще более эффективно окисление проводится перманганатом калия - см. раздел «Кислоты» в § 8. Галогеноводороды и галогеноводородные кислоты.Все галогеноводороды при обычных условиях газообразны. Химическая связь, осуществляемая в их молекулах, - ковалентная полярная, причем полярность связи в ряду падает. Прочность связи также уменьшается в этом ряду. Вследствие своей полярности, все галогеноводороды, в отличие от галогенов, хорошо растворимы в воде. Так, при комнатной температуре в 1 объеме воды можно растворить около 400 объемов объемов и около 400 объемов При растворении галогеноводородов в воде происходит их диссоциация на ионы, и образуются растворы соответствующих галогеноводородных кислот. Причем при растворении и HCI диссоциируют почти полностью, поэтому образующиеся кислоты относятся к числу сильных. В отличие от них, фтороводородная (плавиковая) кислота является слабой. Это объясняется ассоциацией молекул HF вследствие возникновения между ними водородных связей. Таким образом, сила кислот уменьшается от HI к HF. Поскольку отрицательные ионы галогеноводородных кислот могут проявлять только восстановительные свойства, то при взаимодействии этих кислот с металлами окисление последних может происходить только за счет ионов Поэтому кислоты реагируют только с металлами, стоящими в ряду напряжений левее водорода. Все галогениды металлов, за исключением солей Ag и Pb, хорошо растворимы в воде. Малая растворимость галогенидов серебра позволяет использовать обменную реакцию типа как качественную для обнаружения соответствующих ионов. В результате реакции AgCl выпадает в виде осадка белого цвета, AgBr - желтовато-белого, Agl - ярко-желтого цвета. В отличие от других галогеноводородных кислот, плавиковая кислота взаимодействует с оксидом кремния (IV): Так как оксид кремния входит в состав стекла, то плавиковая кислота разъедает стекло, и поэтому в лабораториях ее хранят в сосудах из полиэтилена или тефлона. Все галогены, кроме фтора, могут образовывать соединения, в которых они обладают положительной степенью окисления. Наиболее важными из таких соединений являются кислородсодержащие кислоты галогенов типа и соответствующие им соли и ангидриды.
Государство  Котлеты из геркулеса - очень вкусно, попробуйте!Государство  Королева мечей в таро: значение этого младшего АрканаНепознанное  Как ведут себя лидеры. Известные лидеры | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||