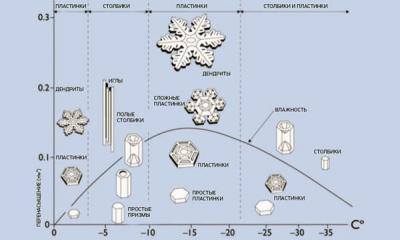
В этой статье мы рассмотрим термодинамические процессы. Ознакомимся с их разновидностями и качественными характеристиками, а также изучим явление круговых процессов, обладающих в начальной и конечной точках одинаковыми параметрами.
Введение
Термодинамическими процессами называют явления, при которых происходит макроскопическое изменение термодинамики всей системе. Наличие разницы между исходным и конечным состоянием носит название элементарного процесса, но при этом необходимо, чтобы это различие было бесконечно малым. Область пространства, в границах которого протекает это явление, именуется рабочим телом.
По типу устойчивость можно различать равновесную и неравновесную. Равновесный механизм представляет собой процесс, в ходе которого все типы состояния, сквозь которые протекает система, относятся к равновесному состоянию. Реализация таких процессов происходит в случае, когда изменение протекает довольно медленно, или, другими словами, явление носит квазистатический характер.
Явление теплового типа можно разделить на обратимый и необратимый термодинамический процессы. К обратимым причисляют механизмы, при которых реализуется возможность проводить процесс в противоположное направление, при помощи одних и тех же промежуточных состояний.
Адиабатическая теплопередача
Адиабатическим путем теплообмена, является термодинамический процесс, происходящий в масштабах макромира. Еще одной характеристикой является отсутствие обмена теплом с пространством вокруг.
Широкомасштабные исследования в области данного процесса уходят стартом развития в начало восемнадцатого века.
Адиабатические типы процессов представляю собой частный случай политропной формы. Это обусловлено тем, что в таком виде равняется нулю, а значит, постоянная величина. Обратить подобный процесс можно лишь при наличии точки равновесия всех моментов во времени. Изменения в показателе энтропии не наблюдаются в таком случае либо протекают слишком медленно. Существует ряд авторов, признающих адиабатические процессы только в обратимых.
Термодинамический процесс газа идеального типа в форме адиабатического явления описывает уравнение Пуассона.
Изохорная система

Механизм изохорического типа - это термодинамический процесс, основанный на постоянной величине объема. Его можно наблюдать в газах или жидкостях, которые достаточно нагревали в сосуде, с неизменным объемом.
Термодинамический процесс идеального газа в изохорической форме, позволяет молекулам сохранять соответствие пропорций по отношению к температуре. Это обуславливается законом Шарля. Для реальных газов данная догма науки не применима.
Изобарная система
Изобарная система представлена в виде термодинамического процесса, который происходит при наличии постоянного давления снаружи. Протекание И.п. в достаточно медленном темпе, позволяющем давлению в пределах системы считаться постоянной и соответствующему показателю внешнего давления может считаться обратимым. Также к таким явлениям можно отнести случай, в котором изменение в выше упомянутом процессе, протекают с маленькой скоростью, позволяющей считать давление постоянным.
Осуществить И.п. можно в системе, подведенной (или отведенной) к теплоте dQ. Для этого необходимо произвести расширение работы Pdv и изменение внутреннего типа энергии dU, T.
- e.dQ, = Pdv+dU= TdS.
Изменения в уровне энтропии - dS, T - абсолютное значение температуры.
Термодинамические процессы идеальных газов в изобарной системе обуславливают наличие пропорциональности объема с температурой. Реальные газы определенное количество теплоты израсходует для внесения изменений в средний тип энергии. Работа такого явление равна показателю произведения давления извне, на изменения в объеме.

Изотермическое явление
Одним из основных термодинамических процессов является его изотермическая форма. Он происходит в физических системах, с постоянным показателем температуры.
Для реализации данного явления систему, как правило, переносят в термостат, с огромным показателем теплопроводности. Взаимный обмен тепла протекает с достаточной скоростью, чтобы обогнать скорость протекания самого процесса. Уровень температуры системы почти не имеет отличий от показателей термостата.
Осуществить процесс изотермической природы также можно с использованием тепловых стоков и (или) источников, проводя контроль постоянства температуры, используя термометры. Одним из самых распространенных примеров такого явления служит кипение жидкостей в условиях постоянного давления.

Изоэнтропийное явление
Изоэнтропийная форма тепловых процессов протекает в условиях постоянной величины энтропии. Механизмы тепловой природы можно получить, используя равенство Клаузиуса для обратимых процессов.
Только обратимые адиабатические процессы можно называть изоэнтропийными. Неравенство Клаузиуса утверждает, что необратимые типы тепловых явлений сюда относиться не могут. Однако постоянство энтропии можно наблюдать и при необратимом тепловом явлении, если работа в термодинамическом процессе над энтропией производится так, что она незамедлительно удаляется. Глядя на термодинамические диаграммы, линии, отображающие изоэнтропийные процессы, можно именовать как адиабаты или изоэнтропы. Чаще прибегают к первому названию, что вызвано отсутствием возможности корректно изображать линии на диаграмме, характеризующейпроцесс необратимого характера. Объяснение и дальнейшая эксплуатация изоэнтропийных процессов имеют огромное значение, так как часто применяется в достижении целей, практическом и теоретическом знании.
Изоэнтальпийный тип процесса

Изоэнтальпийный процесс - тепловое явление, наблюдаемое при наличии энтальпии в постоянной величине. Расчеты ее показателя делаются благодаря формуле: dH = dU + d(pV).
Энтальпией называют параметр, при помощи которого можно охарактеризовать систему, в которой изменения при возврате в обратное состояние самой системы не наблюдаются и, соответственно, равняются нулю.
Изоэнтальпийное явление теплообмена может на примере проявлять себя в термодинамическом процессе газов. Когда молекулы, например этана или бутана, «протискиваются» сквозь перегородку с пористым строением, а с теплом вокруг не наблюдается. Такое можно наблюдать в эффекте Джоуля-Томсона, применяемого в процессе получения сверхнизких показателей температуры. Изоэнтальпийные процессы являются ценными, в силу того, что дают возможность понижать температуру в рамках среды, не тратя для этого энергию.
Политропная форма
Характеристикой политропного процесса является его возможность изменять физические параметры системы, но оставлять показатель теплоемкости (C) в постоянной величине. Диаграммы, отображающие термодинамические процессы в такой форме, именуются политропными. Один из самых простых примеров обратимости отражается в идеальных газах и определяется при помощи уравнения: pV n = const. P - показатели давления, V - объемная величина газа.
«Кольцо» процесса

Термодинамические системы и процессы могут образовывать циклы, которые имеют круговую форму. Они всегда имеют идентичные показатели в начальном и конечном параметре, оценивающем состояние тела. К таким качественным характеристикам можно отнести наблюдение за показателями давления, энтропии, температуры и объема.
Термодинамический цикл находит себя в выражении модели процесса, протекающего в настоящих тепловых механизмах, превращающих тепло в работу механического типа.
Рабочее тело входит в состав компонентов каждой такой машины.
Обратимый термодинамический процесс представлен в виде цикла, который имеет пути проведения как в направлении прямо, так и обратно. Его положение залегает в системе замкнутого типа. Суммарный коэффициент системной энтропии при повторе каждого цикла не изменяется. У механизма, в котором теплопередача происходит только между нагревательным или холодильным аппаратом и рабочим телом, обратимость возможно только при цикле Карно.
Существует ряд других циклических явлений, которые могут обращаться лишь при достижении введения дополнительного резервуара с теплом. Такие источники называют регенераторами.

Анализ термодинамических процессов, в ходе которых происходит регенерация, показывает нам, что все они общие по циклу Рейтлингера. Доказано на ряде расчетов и экспериментов, что обратимый цикл обладает наибольшей степенью эффективности.
Изменение состояния системы, характеризующееся изменением ее термодинамических параметров, называется термодинамическим процессом . Иными словами, если система переходит из исходного состояния в конечное, отличное от исходного, то совершается процесс. Чаще всего в термодинамике рассматриваются следующие процессы:
1) изотермический (T = const ), {греческое therme – жар, теплота};
2) изобарный (р = const ), {греческое baros – тяжесть, вес};
3) изохорный ((V = const ), {греческое chora – пространство};
4) изобарно-изотермический (р = const, Т = const );
5) изохорно-изотермический (V = const, Т = const );
6) адиабатический (отсутствует обмен теплотой между системой и внешней средой).
Процесс, в результате которого система, выйдя из начального состояния и претерпев ряд превращений, вновь в него возвращается, называется круговым процессом или циклом .
Изменение состояния системы может происходить при различных условиях. Поэтому различают в первую очередьравновесные (квазистатические ) и неравновесные процессы. Процесс, рассматриваемый как непрерывный ряд равновесных состояний системы. называется равновесным процессом . При равновесном процессе все параметры системы меняются бесконечно медленно, так что система все время находится в состоянии равновесия.
Чтобы термодинамический процесс осуществлялся квазистатически (равновесно), необходимо выполнение следующих условий :
1. Бесконечно малая разность действующих и противодействующих сил (например, давление в системе на бесконечно малую величину отличается от внешнего давления).
2. Бесконечно медленное течение процесса.
3. Совершение максимальной работы (при неравновесном процессе работа всегда меньше, чем при равновесном и может быть равной нулю – например, расширение идеального газа в вакуум).
4. Изменение внешней силы на бесконечно малую величину меняет направление процесса на обратный.
5. Абсолютные значения работ прямого и обратного процессов одинаковы, а их пути совпадают.
Процесс перехода системы из неравновесного состояния в равновесное называетсярелаксацией , а продолжительность этого процесса – временем релаксации . У различных процессов время релаксации неодинаково: от 10 -7 секунды для установления равновесного давления в газе до нескольких лет при выравнивании концентраций в твердых сплавах.
Следует отметить, что реальные процессы протекают при нарушении равновесия между системой и окружающей средой, при этом возникают потоки энергии и или вещества внутри системы, нарушая в ней равновесие. Поэтому реальные процессы, протекающие с нарушением равновесного состояния системы, являются неравновесными . В классической (феноменологической) термодинамике изучаются только равновесные процессы . Выводы, полученные термодинамикой для равновесных процессов, играют в ней роль своего рода предельных теорем.
Физически бесконечно медленным или квазистатическим (равновесным) изменением какого-либо параметра «а » называют такое его изменение со временем, когда скорость изменения da /dt значительно меньше средней скорости изменения этого параметра при релаксации (здесь t – время). Если при релаксации параметр «а » изменился на Δа , а время релаксации τ , то при равновесных процессах
Если изменение параметра «a » происходит за время t , меньшее или равное времени релаксации τ , так что
то такой процесс является неравновесным или нестатическим .
Кроме понятий равновесных (квазистатических) и неравновесных процессов в термодинамике все процессы делят на обратимые и необратимые . Обратимый термодинамический процесс – процесс перехода термодинамической системы из одного состояния в другое, который может протекать как в прямом, так и в обратном направлении через те же промежуточные состояния без каких бы то ни было изменений в окружающей среде . Если же процесс перехода системы из одного состояние в другое нельзя осуществить в прямом и обратном направлениях без изменения в окружающей среде, то его называют необратимым процессом. Очевидно, что равновесный процесс всегда обратим, а обратимый процесс всегда протекает равновесным путем .
Примеры необратимых процессов :
1. Процесс теплопередачи при конечной разности температур необратим . Обратимый процесс (как равновесный) начинается с состояния равновесия. Наличие разности температур указывает на неравновесность (нестатичность) процесса.
2. Расширение газа в вакуум необратимo , поскольку при таком расширении не совершается работа, а сжать газ так, чтобы не совершить работы, невозможно.
3. Процесс диффузии газов необратим . Если в сосуде с двумя различными газами, разделенными перегородкой, убрать перегородку, то каждый газ будет диффундировать в другой. Для разделения газов каждый из них нужно сжимать. Чтобы они не нагревались, необходимо отнять у них теплоту и превратить в работу, что невозможно без изменения в окружающей среде (второй закон термодинамики).
Термодинамический процесс (тепловой процесс) – изменение макроскопического состояния термодинамической системы. Если разница между начальным и конечным состояниями системы бесконечно мала, то такой процесс называют элементарным (инфинитезимальным).
Система, в которой идёт тепловой процесс, называется рабочим телом.
Тепловые процессы можно разделить на равновесные и неравновесные. Равновесным называется процесс, при котором все состояния, через которые проходит система, являются равновесными состояниями. Такой процесс приближённо реализуется в тех случаях, когда изменения происходят достаточно медленно, т. е. процесс является квазистатическим.
Тепловые процессы можно разделить на обратимые и необратимые. Обратимым называется процесс, который можно провести в противоположном направлении через все те же самые промежуточные состояния.
Виды тепловых процессов:
Адиабатный процесс - без теплообмена с окр. средой;
Изохорный процесс - происходящий при постоянном объёме;
Изобарный процесс - происходящий при постоянном давлении;
Изотермический процесс - происходящий при постоянной температуре;
Изоэнтропийный процесс - происходящий при постоянной энтропии;
Изоэнтальпийный процесс - происходящий при постоянной энтальпии;
Политропный процесс - происходящий при постоянной теплоёмкости.
Уравнение Менделеева-Клайперона (уравнение состояния идеального газа):
PV = nRT, где n – число молей газа, P – давление газа, V – объем газа, T – температура газа, R – универсальная газовая постоянная
Изопроцессы идеального газа. Их изображение в P - V диаграммах.
1) Изобарный процесс p = const, V/T = const



2) Изохорный процесс V = const, p/T = const



3) Изотермический процесс T = const, pV = const



Термодинамические процессы. Уравнение Менделеева-Клапейрона. Изопроцессы идеального газа. Их изображение на Р- V диаграммах.
Термодинамические процессы. Совокупность изменяющихся состояний рабочего тела называется термодинамическим процессом.
Идеальный газ - изучаемый в термодинамике воображаемый газ, у которого отсутствуют силы межмолекулярного притяжения н отталкивания, а сами молекулы представляют собой материальные точки, не имеющие объема. Многие реальные газы по своим физическим свойствам весьма близки к идеальному газу.
Основными процессами в термодинамике являются:
изохорный , протекающий при постоянном объеме;
изобарный , протекающий при постоянном давлении;
изотермический , происходящий при постоянной температуре;
адиабатный , при котором теплообмен с окружающей средой отсутствует;
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv =RT) следует:
p/T =R/v = const,
т. е. давление газа прямо пропорционально его абсолютной температуре:
p 2 /p 1 =T 2 /T 1 .
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при c v
q =c v (T 2 - T 1 ).
Т. к.l = 0, то на основании первого закона термодинамики Δu =q , а значит изменение внутренней энергии можно определить по формуле:
Δu =c v (T 2 - T 1 ).
Изменение энтропии в изохорном процессе определяется по формуле:
s 2 – s 1 = Δs = c v ln(p 2 /p 1 ) = c v ln(T 2 /T 1 ).
Изобарный процесс

Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
v / T =R / p =const
v 2 /v 1 =T 2 /T 1 ,
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
l =p (v 2 – v 1 ).
Т. к. pv 1 =RT 1 иpv 2 =RT 2 , то
l =R (T 2 – T 1 ).
Количество теплоты при c p = const определяется по формуле:
q =c p (T 2 – T 1 ).
Изменение энтропии будет равно:
s 2 – s 1 = Δs = c p ln(T 2 /T 1 ).
Изотермический процесс

При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
pv = RT = const
p 2 / p 1 =v 1 / v 2 ,
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
l =RT ln (v 2 – v 1 ) =RT ln (p 1 – p 2 ).
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
q =l.
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
s 2 – s 1 = Δs =R ln(p 1 /p 2 ) =R ln(v 2 /v 1 ).
Адиабатный процесс

Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
du +p dv = 0
Δu +l = 0,
следовательно
Δu = -l.
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через c ад, и условие dq = 0 выразим следующим образом:
dq =c ад dT = 0.
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (c ад = 0).
Известно, что
с p /c v =k
и уравнение кривой адиабатного процесса (адиабаты) в p, v -диаграмме имеет вид:
pv k = const.
В этом выражении k носит названиепоказателя адиабаты (так же ее называют коэффициентом Пуассона).
Значения показателя адиабаты k для некоторых газов:
k воздуха = 1,4
k перегретого пара = 1,3
k выхлопных газов ДВС = 1,33
k насыщенного влажного пара = 1,135
Из предыдущих формул следует:
l = - Δu = c v (T 1 – T 2 );
i 1 – i 2 = c p (T 1 – T 2 ).
Техническая работа адиабатного процесса (l техн) равна разности энтальпий начала и конца процесса (i 1 – i 2 ).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным . ВT, s -диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называетсяреальным адиабатным процессом .
Уравнение Менделеева-Клапейрона
Газы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных.
Для этого используют уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = n RT
где n – число молей газа;
P – давление газа (например, в атм ;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная (0,0821 л·атм /моль·K).
Например, в колбе объемом 2,6 л находится кислород при давлении 2,3 атм и температуре 26 о С. Вопрос: сколько молей O 2 содержится в колбе?
Из газового закона найдем искомое число молей n :
Не следует забывать преобразовывать температуру из градусов Цельсия в кельвины: (273 о С + 26 о С) = 299 K. Вообще говоря, чтобы не ошибиться в подобных вычислениях, нужно внимательно следить за размерностью величин, подставляемых в уравнение Клапейрона-Менделеева. Если давление дается в мм ртутного столба, то нужно перевести его в атмосферы, исходя из соотношения: 1атм = 760 мм рт. ст. Давление, заданное в паскалях (Па), также можно перевести в атмосферы, исходя из того, что 101325 Па = 1атм .
Билет 16
Вывод основного уравнения молекулярно-кинетической теории. Число степеней свободы молекулы. Закон распределения энергии по степеням свободы.
Вывод основного уравнения МКТ.



Число степеней свободы молекулы. Закон распределения энергии по степеням свободы.


Билет 17.
Первое начало термодинамики. Работа газа при изменении объема. Вычислить работу изотермического расширения газа.
Количество теплоты , полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. В циклическом процессе внутренняя энергия не изменяется.





Работа при изотермическом расширении газа вычисляется как площадь фигуры под графиком процесса.


Билет 18.
Теплоемкость идеального газа.
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. c = Q / (mΔT).
где M – молярная масса вещества.
Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры.
Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: C V – молярная теплоемкость в изохорном процессе (V = const) и C p – молярная теплоемкость в изобарном процессе (p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
где R – универсальная газовая постоянная. При p = const
Таким образом, соотношение, выражающее связь между молярными теплоемкостями C p и C V , имеет вид (формула Майера):
|
C p = C V + R. |
Молярная теплоемкость C p газа в процессе с постоянным давлением всегда больше молярной теплоемкости C V в процессе с постоянным объемом
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом играет важную роль в термодинамике. Оно обозначается греческой буквой γ.
Билет 19.
Цикл Карно. Тепловая и холодильная машины. КПД цикла Карно.
В термодинамике цикл Карно́ или процесс Карно - это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой - холодильником.
Цикл Карно назван в честь французского учёного и инженера Сади Карно, который впервые его описал в своём сочинении «О движущей силе огня и о машинах, способных развивать эту силу» в 1824 году.
Поскольку обратимые процессы могут осуществляться лишь с бесконечно малой скоростью, мощность тепловой машины в цикле Карно равна нулю. Мощность реальных тепловых машин не может быть равна нулю, поэтому реальные процессы могут приближаться к идеальному обратимому процессу Карно только с большей или меньшей степенью точности. В цикле Карно тепловая машина преобразует теплоту в работу с максимально возможным коэффициентом полезного действия из всех тепловых машин, у которых максимальная и минимальная температуры в рабочем цикле совпадают соответственно с температурами нагревателя и холодильника в цикле Карно
Пусть тепловая машина состоит из нагревателя с температурой Тн, холодильника с температурой Тх и рабочего тела .
Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две - при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура ) и S (энтропия ).
1. Изотермическое расширение (на рис. 1 - процесс A→Б). В начале процесса рабочее тело имеет температуру Тн, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Q. При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает.
2. Адиабатическое расширение (на рис. 1 - процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом температура тела уменьшается до температуры холодильника Тх, тело совершает механическую работу, а энтропия остаётся постоянной.
3. Изотермическое сжатие (на рис. 1 - процесс В→Г). Рабочее тело, имеющее температуру Тн, приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты Q. Над телом совершается работа, его энтропия уменьшается.
4. Адиабатическое сжатие (на рис. 1 - процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается под действием внешней силы без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя, над телом совершается работа, его энтропия остаётся постоянной.
Обратный цикл Карно
В термодинамике холодильных установок и тепловых насосов рассматривают обратный цикл Карно , состоящий из следующих стадии: адиабатического сжатия за счёт совершения работы (на рис. 1 - процесс В→Б); изотермического сжатия с передачей теплоты более нагретому тепловому резервуару (на рис. 1 - процесс Б→А); адиабатического расширения (на рис. 1 - процесс А→Г); изотермического расширения с отводом теплоты от более холодного теплового резервуара (на рис. 1 - процесс Г→В).


Билет 20.
Второе начало термодинамики. Энтропия. Третье начало термодинамики.
Второе начало термодинамики - физический принцип, накладывающий ограничение на направление процессов, которые могут происходить в термодинамических системах .
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода , показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю (невозможно построить замкнутый цикл, проходящий через точку с нулевой температурой).
Второе начало термодинамики является постулатом , не доказываемым в рамках классической термодинамики . Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Постулат Клаузиуса : «Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому» (такой процесс называется процессом Клаузиуса ).
Постулат Томсона (Кельвина) : «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона ).
Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии ).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
Третье начало термодинамики (теорема Нернста ) - физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю . Является одним из постулатов термодинамики , принимаемым на основе обобщения значительного количества экспериментальных данных.
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система» .
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение). Третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю.
Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать в рамках классической термодинамики (на основе первого и второго начал термодинамики).
Термодинамическая энтропия S , часто просто именуемая энтропия , - физическая величина , используемая для описания термодинамической системы , одна из основных термодинамических величин . Энтропия является функцией состояния и широко используется в термодинамике , в том числе химической .


Термодинамический процесс
| Наименование параметра | Значение |
| Тема статьи: | Термодинамический процесс |
| Рубрика (тематическая категория) | Математика |
Лекция 2
ПДК выбрососв АЭС 0,05 Зв/год для персонала0,005Зв/год для населения вблизи
Термодинамическая система может произвести полезную работу только при условии, в случае если в ней осуществляется термодинамический процесс. В этом случае изменяются и основные термодинамические параметры Р, v и Т. Термодинамический процесс - это совокупность изменений состояний термодинамической системы при её переходе из одного состояния в другое.
Мы будем рассматривать только равновесные термодинамические процессы , протекающие в равновесных системах. Равновесным состоянием системы принято называть состояние, когда во всех точках системы давления и температуры одинаковы. Система, выведенная из состояния равновесия и предоставленная при постоянных параметрах окружающей среды самой себе, через неĸᴏᴛᴏᴩᴏᴇ время вновь придет в равновесное состояние, соответствующее этим параметрам. Процесс, проходящий через чередующиеся равновесные состояния системы принято называть равновесным процессом .
В противном случае система неравновесна . Все процессы, протекающие в реальном времени, как правило, неравновесны. Допущение о существовании равновесных систем основано на том, что любая система, выведенная из состояния равновесия и предоставленная при постоянных параметрах окружающей среды самой себе, через неĸᴏᴛᴏᴩᴏᴇ время вновь придет в равновесное состояние. Такое самопроизвольное (без внешнего воздействия) возвращение системы в состояние равновесия принято называть релаксацией , а промежуток времени, в течение которого реальная система возвращается в состояние равновесия, принято называть временем релаксации . В случае если реальный процесс протекает медленнее, чем идёт релаксация, то процесс является равновесным. Дли разных процессов и разных параметров время релаксации различно. Внутренними процессами, компенсирующими нарушение равновесия при изменение состояния тела и восстанавливающими термодинамическое равновесие, являются элементарные процессы обмена энергией при столкновении молекул.
Интересно отметить, что превращение энергии поступательного движения молекул в энергию вращательного движения и обратно при столкновении молекул происходит весьма быстро. Так, давление в объёме выравнивается со скоростью звука (более 340 м/с в воздухе при нормальных физических условиях). Температура – значительно медленнее. Связано это с тем, что превращение энергии поступательного или вращательного движения молекул в колебательное при росте температуры осуществляется сравнительно медленно. Вообще все процессы обмена энергии, в которых участвуют колебательные степени свободы движения молекул, требуют для своего осуществления сравнительно большого времени.
Рассмотрим, к примеру, процесс сжатия газа в цилиндре. В случае если время смещения поршня от одного положения до другого существенно превышает время релаксации, то в процессе перемещения поршня давление и температура успеют выровняться по всему объёму цилиндра. Это выравнивание обеспечивается непрерывным столкновением молекул, в результате чего подводимая от поршня к газу энергия достаточно быстро и равномерно распределяется между ними. В случае если последующие смещения поршня будут происходить аналогичным образом, то состояние системы в каждый момент времени будет практически равновесным.
Теоретически равновесный процесс можно осуществить только при бесконечно медленном изменении состояний системы и внешних условий. В этом смысле время как действующий физический фактор в равновесных процессах не применяется.
Уравнение состояния F (Р, v, Т) = 0 в трёхосной системе координат Р, v и Т представляют из себяповерхность, называемую термодинамической поверхностью . В случае если рассечь эту поверхность (рис. 1.8) плоскостями параллельными осям координат, то получим кривые. К примеру, сечение плоскостью Т = const даёт линию изменения давления исходя из объёма в координатах Р и v , Описываемый процесс принято называть изотермным. В термодинамике чаще всего применяют двухосную систему с координатами Р и v (рис. 1.9).
 |
Процесс должна быть прямым и обратным. В случае если система с параметрами Р 1 и v 1 (точка 1) переходит в состояние 2 с параметрами Р 2 и v 2 , а затем возвращается в состояние 1, то такой процесс принято называть обратимым (рис. 1.9).Обратимым принято называть равновесный процесс, проходящий в прямом и обратном направлениях через ряд одинаковых состояний. В обратной последовательности состояний равновесного процесса рабочее тело и внешняя среда возвращаются в исходное состояние.
Процессы, не соответствующие этому условию, называются необратимыми . Все реальные процессы необратимы.
В начальном курсе термодинамики рассматриваются равновесные обратимые процессы, происходящие в закрытых (ΔМ = 0) системах:
1) изохорный, протекающий при неизменном объёме (v = const);
2) изобарный, протекающий при неизменном давлении (p = const);
3) изотермный, протекающий при неизменной температуре (Т = const);
4) адиабатный, совершающийся при отсутствии теплообмена (ΔQ =0);
5) политропный, обобщающий, процесс, частными случаями котоpoгo являются первые четыре процесса.
Особое значение имеют замкнутые процессы (или круговые). Это такие процессы, при которых система проходит ряд последовательных состояний, возвращаясь к первоначальному. Иначе такой процесс принято называть циклом (рис. 1.10).
2.1.Теплоёмкость идеальных газов
 В случае если возьмём любое рабочее тело и сообщим ему тепло в любом процессе, то изменяется его состояние, к примеру, в частном случае, увеличивается его температура. (рис.3.1).
В случае если возьмём любое рабочее тело и сообщим ему тепло в любом процессе, то изменяется его состояние, к примеру, в частном случае, увеличивается его температура. (рис.3.1).
Отношение элементарного количества теплоты δQ , полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела dT принято называть теплоёмкостью рабочего тела в данном процессе :
C = δQ/dT. (1)
(Причина применения разных символов δ или d приэлементарных количествах теплоты и температуры будет объяснена ниже).
Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, в связи с этим теплоемкость является функцией процесса . Это означает, что одно и то же рабочее тело исходя из процесса требует для своего нагревания на 1 К различного количества теплоты. Численно величина с изменяется в пределах от + ∞ до - ∞. При этом разница является суммой разниц внутренней энергии и работ процессов.
Обычно теплоемкость относят к единице количества вещества (отсюда название - удельная теплоёмкость) и в зависимости от выбранной единицы различают:
-удельную массовую теплоёмкость с , отнесенную к 1 кг вещества, Дж/(кг-К);
-удельную объёмную теплоёмкость с" , отнесенную к количеству вещества, содержащегося в 1 м 3 объёма при нормальных физических условиях, Дж/(м 3 -К);
-удельную мольную теплоёмкость с μ , отнесенную к одному киломолю вещества, Дж/(кмоль-К).
Массовая удельная теплоёмкость (с) равна:
с = с х / m, [Дж / (кг ‣‣‣ К)].
Объёмная удельная теплоёмкость с" - это отношение теплоёмкости однородного тела к его объёму при нормальных условиях.
с" = c x /V 0 , [Дж/(м 3 -К)], где V 0 - объём произвольного количества газа при нормальных физических условиях.
Молярная теплоёмкость µс равна:.
µс [Дж / (моль ‣‣‣ К)], µ - молярная масса вещества [кг / моль].
Зависимость между удельными теплоёмкостями устанавливается очевидными соотношениями:
с" = с ‣‣‣ρ н ; c μ =c ‣‣‣μ или c = µc/µ = c’/p o =c’·22,414/µ
Здесь ρ н - плотность газа при нормальных условиях, [кг / м 3 ]. Из уравнения (1): δq x = с х · dТ
можно найти количество тепла, сообщённого телу в течение процесса
∫ δq x = q 1,2 = ∫ c x · dT .
Изохорная теплоёмкость
В термодинамических расчетах большое значение имеет теплоемкость при постоянном объёме
c v = δq v / dT v . (2)
Она равна отношению количества теплоты δq v , подведенной к телу в процессе при постоянном объёме, к изменению температуры тела dТ v ;
Теплоемкость при постоянном давлении
c р =δq p / dT p (10)
и равная отношению количества теплоты δq p ,сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT p .
| Теплоёмкость некоторых газов при температуре 0 0 С | |||
| Газ | Число степеней свободы | Мольная тепло- емкость, кДж/ (кмоль- К) | k=Cр / Cv |
| Гелий Не | 3 | 12,60 | 1,660 |
| Аргон Аr | 3 | 12,48 | 1,660 |
| Кислород О 2 | 5 | 20,96 | 1,397 |
| Водород Н 2 | 5 | 20,30 | 1,410 |
| Азот N 2 | 5 | 20,80 | 1,400 |
| Метан СH 4 | 6 | 26,42 | 1,315 |
| Аммиак NH 3 | 6 | 26,67 | 1,313 |
| Диоксид угле- рода СО 2 | 6 | 27,55 | 1,302 |
| Перегретый водяной пар Н 2 О | 6 | 1,30 |
Обычно теплоемкости определяются экспериментально, но для многих веществ их можно рассчитать методами статистической физики. Числовое значение теплоемкости идеального газа позволяет найти классическая теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул. Согласно этой теореме внутренняя энергия идеального газа прямо пропорциональна числу степеней свободы молекул и энергии kT/2 , приходящейся на одну степень свободы. Здесь k является коэффициентом пропорциональности и принято называть постоянной Больцмана (австрийский физик Людвиг Больцман, 1844-1906), равной 1,380∙10 -23 Дж/К. Число степеней свободы позволяют полностью определить положение молекулы в пространстве.
Молекула одноатомного газа имеет три степени свободы соответственно трем составляющим в направлении координатных осей, на которые должна быть разложено поступательное движение. Молекула двухатомного газа имеет пять степеней свободы, так как помимо поступательного движения она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы. Молекула трехатомного и вообще многоатомного газа имеет шесть степеней свободы: три поступательных и три вращательных.
Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур, однако основной вывод о независимости от температуры эксперимент не подтверждает. Расхождения, особенно существенные в области низких и достаточно высоких температур, связаны с квантовым поведением молекул и находят объяснения в рамках квантовой теории теплоемкости.
С уменьшением температуры газа происходит ʼʼвымораживаниеʼʼ числа степеней свободы молекул. Так, для двухатомной молекулы происходит ʼʼвымораживаниеʼʼ вращательных степеней свободы и она вместо пяти имеет три степени свободы, а следовательно, и меньшую внутреннюю энергию и теплоемкость. С увеличением температуры у многоатомных молекул происходит возбуждение внутренних степеней свободы за счёт возникновения колебательного движения атомов молекулы (молекула становится осциллятором). Это приводит к увеличению внутренней энергии, а следовательно, и теплоемкости с ростом температуры.
Выведем уравнение изохорной теплоёмкости. Первый закон термодинамики для равновесного процесса записывается так:
δq = du + p ‣‣‣ dv (3) Так как удельная внутренняя энергия u является полным дифференциалом, то можно её определить исходя из двух любых параметров, к примеру от Т и v: и = f (T, v), тогда можно записать;
du = (∂u/∂T)v ‣‣‣ dT + (∂u/∂υ)т ‣‣‣ dυ (4)
Подставим значение du из (4) в уравнение"(3):
δq = (∂u/∂T)v · dT + (∂u/∂υ)т · dυ + p · dυ
δq = (∂u/∂T)v · dT + · dυ (4")
Так как в изохорном процессе υ = const, то dυ = 0. Тогда имеем:
δq v = (∂u/∂T)v · dT v , (5)
а теплоёмкость в изохорном процессе равна:
c v = δq v /dT v = (δu/∂T)v · (dT v /dT v) = (∂u/∂T)v (6)
c v = (∂u/∂T)v (6’)
Используя выражения (3), (5), (6) можно записать:
δq v = du v = c v · dT v (7)
To есть в процессе при v = const, когда тело не совершает внешней работы вся теплота͵ подведённая к телу расходуется на изменение его удельной внутренней энергии.
Принимая с v = const, можно записать из (7):
q 1-2, v = u 2 – u 1 = c v · (T 2 – T 1) (8) Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, изменение удельной внутренней энергии идеального газа равно произведению теплоёмкости с v при постоянном объёме, на разность температур тела.
Из уравнения (4") при р = const имеем:
δq p = (ди/ дТ) V · dT p + [ р + (ди / дυ)т ] ‣‣‣ dυ P (9)
Учитывая выражение (9) можно записать:
Ср = (ди/ дТ)v + [ р + (ди / дυ)т ] ‣‣‣ (дυ/dT)р
Используя уравнение (6 ’) запишем:
c p = c v + [ р + (ди / дυ)т ] ‣‣‣ (дυ/dT)р (11)
Для идеального газа. (дu / дv) T = 0, а так как R = р · v I T, то дифференцируя его при р = const, имеем:
R = p · (dυ/dT)p, (12)
Подставляя (12) в (11) имеем окончательно:
с р = c v + R . (13)
Для реальных газов с р - c v > R, так как при расширении (при р = const) совершается не только внешняя, но и внутренняя работа͵ связанная с изменением внутренней потенциальной энергией газа, что вызывает дополнительный расход теплоты.
Термодинамический процесс - понятие и виды. Классификация и особенности категории "Термодинамический процесс" 2017, 2018.